公司一切文件都采用先进的电子文件管理系统,系统符合美国21CFR Part 11,从而最大限度地保证了文件的真实性、可靠性、管理上的高效性和成本上的绿色环保性。
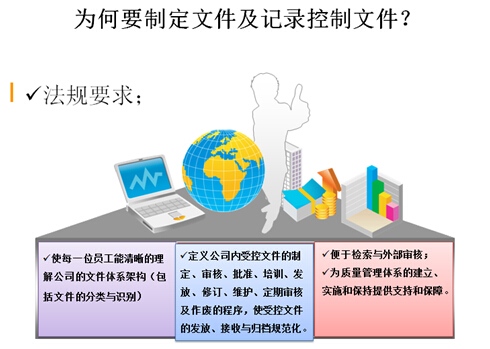
符合21 CFR Part 11
21
CFR Part
11是美国在1997年8月颁布的一项FDA的规定,属于美国联邦法规第21章第11款,阐明有关电子记录和电子签名的检查认可标准的最低要求。这项标准的提出是行业要求的体现。在规定中,电子记录、电子签名被认为具有与书面记录和手写签名同等的效力。
整个21
CFR是美国联邦法律中关于食品和药品的部分,也就是属于FDA(美国食品和药品管理局)管辖的范围,一共有Part
1到1499。21 CFR Part 11是第十一部分。
我们耳熟能详的一些规范,包括良好实验室操作规范(GLP)、良好临床试验操作规范(GCP)和良好生产操作规范(GMP)都是属于21
CFR。另外包括了许多关于生物医药领域信息系统和自动化设备等的规定。
作为美国的法律,被美国的生物医药企业、医院、研究所和实验室广泛接受和遵照执行,美国作为全球生物医药产业最主要组成部分影响力巨大,当你的药物、生物医药相关设备或者信息系统需要销售给美国的制药企业和研究人员都应该符合21
CFR Part 11的规定。如违反,FDA能够根据规定剥夺出口到美国的权利。 21 CFR Part
11从1997年颁布以来已被推广至全球,虽然没有强制性,但被欧洲、亚洲等地图和国家普遍接受和使用。其他国家对电子记录和电子签名也有类似问题,会以21
CFR Part 11的相关规定为指导原则,来制定本国的相关法规。
随着CFDA的发展,陆续推出了我国的良好实验室操作规范(GLP)、良好临床试验操作规范(GCP)和良好生产操作规范(GMP),但我国国内暂无像21
CFR Part
11这样在生物医药领域针对电子记录和电子签名的规范或标准。我国在2005年开始实施了《中华人民共和国电子签名法》,但这主要针对容易引起法律纠纷如合同、协议等的电子签名有效性的规定。另外,21
CFR Part 11的规定是完全符合质量管理中关于记录控制的要求的。
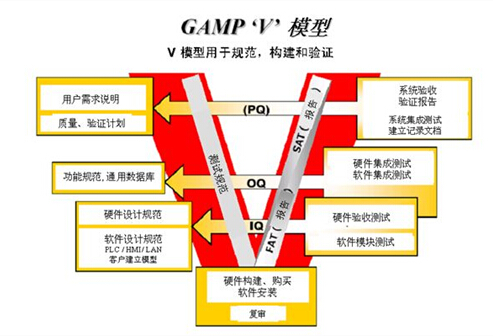
计算机系统验证: